Waarom gasdetectie??
Waarom heb je überhaupt gasdetectoren nodig?
In de loop van de evolutie hebben mensen zich aangepast aan de atmosfeer van de aarde. Het menselijk organisme functioneert optimaal in grofweg 21% zuurstof en 79% stikstof. Alomtegenwoordige sporengassen zoals bijvoorbeeld CO2 en edelgassen worden verwaarloosd. Kleine afwijkingen in de samenstelling beïnvloeden het welzijn, grotere hebben invloed op de gezondheid en zeer grote kunnen fataal zijn. Giftige gassen kunnen zeer schadelijk zijn voor de gezondheid, zelfs in zeer lage concentraties. Er wordt onderscheid gemaakt tussen de volgende gevaren:
- Te kort aan zuurstof
- Aanwezigheid van explosieve gassen
- Aanwezigheid van giftige gassen
Bovengenoemde afwijkingen kunnen zowel in de natuur voorkomen als door de mens worden veroorzaakt. In onze industriële samenleving overheerst dit laatste. Typische voorbeelden van natuurlijke afwijkingen zijn rottingsprocessen waarbij zowel brandbare gassen (methaan) als giftige gassen (waterstofsulfide, kooldioxide, mercaptanen, etc.) vrijkomen. Deze gassen hebben de neiging zich op te hopen in putten of depressies. Een typisch ongeval is het zogenaamde beerputongeval: iemand komt te dicht bij een beerput en inhaleert waterstofsulfide, wat tot ademhalingsverlamming leidt. Het slachtoffer valt in de put en verdrinkt of stikt. Mensen die hem proberen te helpen ondergaan hetzelfde lot.
Toch is het niet gebruikelijk om gasdetectoren op boerderijen te hebben. Heel anders bij afvalwatertechnologiebedrijven. Soortgelijke verrottingsprocessen vinden plaats in hun poelen. Zelfs de inlaat in het gebied van de schermen wordt met behulp van stationaire meettechniek gecontroleerd op brandbare gassen. Het binnenkomende afvalwater kan al methaan uitstoten of brandstoffen of oplosmiddelen vervoeren. In de werkruimtes zijn medewerkers uitgerust met apparaten die zelfs meerdere gassen kunnen detecteren. Meestal meten deze ontvlambare gassen, zuurstofgebrek, kooldioxide en waterstofsulfide.
- Een reis door de geschiedenis
Het is al sinds de oudheid bekend dat bij alcoholische gisting gevaarlijke gassen ontstaan. Sinds mensenheugenis plaatsen wijnmakers een kaars op de vloer van hun gistingkelder, en als deze door zuurstofgebrek uitgaat, moeten ze de kelder verlaten. Natuurlijk konden ze niet eerder weten dat het gevaar werd veroorzaakt door kooldioxide. Ze wisten ook niet dat kooldioxide bij slechts 0,5% giftig is, maar dat de kaars pas bij ongeveer 10% uitgaat.
Een ander typisch voorbeeld van in de natuur voorkomende gassen is de mijnbouw. Het zogenaamde ‘opvallende weer’ bevat giftig koolmonoxide en explosief methaan. Het is dan ook niet verwonderlijk dat er al heel vroeg pogingen zijn ondernomen om het gevaar van gas tijdig te onderkennen, vooral in de mijnbouw. Kort na de geboorte van Christus waren mensen zich bewust van de gevaren voor de gezondheid van een afbraak van bijvoorbeeld Mercurius. Dit wordt beschreven in een geschrift van Plinius de Oudere rond 100 na Christus. Mensen probeerden tevergeefs zichzelf te beschermen met maskers gemaakt van varens.
Latere auteurs (1556 Georgius Agricola: “De Re Metallica”, rond 1700 en Bernardino Ramazzini: “De Morbis Artificium Diatribe”) waren ook op de hoogte van de gevaren van gas in de mijnbouw. Er is echter geen manier bekend om het gas te detecteren. Omdat mensen toen nog niet eens wisten wat een gas was, zou dit moeilijk zijn geweest. Daarom lijkt het redelijk om te concluderen dat er geen manier was om te beoordelen of de atmosfeer gevaarlijk was.
Omdat de Industriële Revolutie vereiste dat er steeds meer steenkool moest worden gewonnen, nam de noodzaak om gevaarlijke gassen te meten toe. Let op: Men wist niet welke stoffen het gevaar veroorzaakten, maar wel van de aanwezigheid van een diffuus gevaar.
Om potentieel gevaarlijke gassen te elimineren, werden specialisten, zogenaamde ‘brandweerlieden’, vooruit gestuurd. Brandbaar methaan is specifiek lichter dan lucht en hoopt zich daarom op onder het plafond. De brandweerlieden hielden een kaars dicht bij het plafond, zodat het methaan ontstak. Deze methode was allesbehalve veilig. Als zich in plaats van hoogverrijkt methaan een explosieve atmosfeer zou hebben gevormd, zou dit fatale gevolgen kunnen hebben. Brandweerman was een zeer gevaarlijk beroep.
Rond het midden van de 18e eeuw werd opgemerkt dat gevaarlijke stoffen het uiterlijk van een kaarsvlam konden veranderen. Om de kaars als ontstekingsbron onschadelijk te maken, werd geprobeerd de vlam met behulp van waterkolommen van de atmosfeer te scheiden. Deze procedure was echter zeer ingewikkeld. Uiteindelijk kreeg het idee van Humphrey Davy om de vlam van de atmosfeer te scheiden met behulp van fijnmazige metalen netten de overhand. De eerste Davy-lampen werden in 1816 in Engeland getest. Dit waren olielampen waarvan de vlam brandde achter een primitief type vlamdover.
Meer dan 150 jaar lang was de originele Davy-lamp, en na verloop van tijd met enkele verbeteringen, de enige manier om gas te detecteren. Er zijn pogingen gedaan om het gemakkelijker te maken de hoogte van de vlam in te schatten door een schaalverdeling te bevestigen. De installatie van een bimetaalsensor kan worden omschreven als een voorloper van de vlamtemperatuurmeting. (Hoe meer methaan er was, hoe meer brandstof beschikbaar was, hoe heter de vlam brandde en hoe groter de afbuiging van het bimetaal.
Ze hadden nu een hulpmiddel waarmee ze licht konden genereren en waarmee ze – met enige ervaring – de aanwezigheid van gevaarlijke gassen konden inschatten. Dit proces was echter afhankelijk van de omgevingslucht die voldoende zuurstof bevatte. Helaas is dit onder de grond geenszins veilig. Gelukkig zijn de gasmeetmethoden sindsdien steeds verfijnder geworden.
Dus terug naar het heden.
- Hoe werken moderne gasdetectoren?
2.1 Meting van brandbare gassen
2.1.1 Katalytische sensoren
Deze sensoren profiteren van het vermogen van brandbare materialen om bij verbranding energie vrij te geven. Daarom worden ze ook wel heat toning-sensoren genoemd. Bij het branden van b.v. Methaan gebeurt het volgende:
CH4 + 2 O2 -> CO2 + 2 H2O + energie
Hoe meer methaan er in de lucht zit, hoe groter de energie die vrijkomt bij deze reactie. Nu hoefde er alleen nog maar een regeling te worden bedacht waarmee de uitgezonden energie nauwkeurig kon worden bepaald. Hiervoor worden twee keramische kralen (ook wel pellistors genoemd) gebruikt, die beide door een platinaspiraal aan de binnenkant tot ca. 400 °C worden verwarmd. Eén van de spoelen is katalytisch gecoat. Het methaan wordt aan het oppervlak geoxideerd, d.w.z. H. Er komt energie vrij, waardoor de spoel verder opwarmt. Deze verwarming verhoogt de elektrische weerstand van de spoel. De tweede spoel is niet katalytisch gecoat en er vindt geen oxidatie plaats. Door te vergelijken met dit passieve element wordt het signaal gecompenseerd voor externe temperatuurschommelingen, luchtstroom, vochtigheid etc. omdat deze invloeden beide keramische kralen op dezelfde manier beïnvloeden.
Een zeer nauwkeurige methode om weerstandsveranderingen te meten is de Wheatstone-brug.
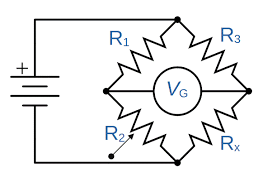
De twee spiralen zijn verbonden als takken van een Wheatstone-brug. Met deze methode kun je heel precies de weerstandsverandering meten, en daarmee indirect het brandstofgehalte van de atmosfeer. Dit signaal kan worden gebruikt om te beoordelen of de atmosfeer explosief is of niet. Je wilt de werkelijke concentratie niet weten. U wilt gewoon weten of er explosiegevaar bestaat of niet. Daarom is het meetbereik ingesteld op 0 – 100% LEL (= onderste explosiegrens). Helaas is de LEL een stofspecifieke grootheid. Je moet dus weten met welk gas je te maken hebt. Dan moet je in de literatuur kijken welke concentratie van dit gas de LEL is.
Het wordt lastig als er gasmengsels kunnen ontstaan. Omdat je de proportionele samenstelling meestal niet kunt voorspellen, kun je gebruik maken van een zogenaamde veiligheidskalibratie. Je stelt je meetapparaat niet in op het verwachte gasmengsel, maar op een stof die met minder gevoeligheid wordt gedetecteerd. Nonaan wordt vaak gebruikt omdat het een zeer lage LEL heeft. Omdat nonaan echter een vloeistof is, zou kalibratie voor nonaan in het veld erg omslachtig zijn. Het is moeilijk en daarom onderhevig aan grote fouten om een nauwkeurig gasmengsel te produceren uit een vloeistof in het veld.
Daarom biedt Compur Monitors “dubbele kalibratie”. De kalibratie wordt in het laboratorium uitgevoerd met nonaan en een tweede keer met een referentiegas, b.v. butaan. De referentiefactor wordt op de sensor genoteerd, zodat de gebruiker ter plaatse gemakkelijk kan kalibreren met een lucht/butaanmengsel uit een standaardfles. Vervolgens past hij hierop de referentiefactor toe.
Katalytische sensoren hebben veel voordelen:
- Ze reageren op alles wat brandt.
- Ze zijn erg goedkoop.
- Ze hebben een lange levensduur.
Natuurlijk zijn er ook nadelen:
- Je hebt zuurstof nodig
- Ze kunnen ongevoelig worden voor katalysatorvergiften (siliconen, zware metalen, corrosieve gassen).
- Vergiftiging wordt niet opgemerkt.
2.1.2 Infraroodsensoren
Veel gassen absorberen licht op een zeer specifieke golflengte. Elk molecuul neemt een bepaald aantal lichtkwanta uit een lichtstraal. Deze energie wordt gebruikt om bepaalde elektronen in het molecuul te laten trillen. Gelukkig treedt dit effect alleen op bij zeer specifieke golflengten. Door de golflengte correct te selecteren, kun je bepalen welk gas het apparaat moet meten. Voor het meten van koolwaterstoffen wordt 3,4 μ gekozen. Bij deze golflengte absorbeert de C – H-binding van de koolwaterstoffen. Dus als je de hoeveelheid geabsorbeerde energie kunt meten, kun je de hoeveelheid gasmoleculen in het lichtpad afleiden.
Een infrarood gasdetector is als volgt opgebouwd: Er wordt een lichtstraal door een cuvet gestuurd, aan het uiteinde waarvan zich een lichtdetector bevindt.
Hoe minder licht de detector ontvangt, hoe meer gas er in de cuvet zit. Om andere omgevingsinvloeden zoals vochtigheid, druk of temperatuur te compenseren, wordt een tweede straal met een andere golflengte gebruikt. Om licht van een specifieke golflengte te genereren, worden filters, optische roosters, prisma’s of zelfs LED-lichtbronnen van een specifieke kleur gebruikt.
Je kunt net zo gemakkelijk een enkele lichtbundel achter de cuvet splitsen in twee bundels met verschillende golflengten.
Infraroodsensoren hebben enkele voordelen:
- Ze hebben geen zuurstof nodig
- Ze kunnen niet vergiftigd worden
- Door gebruik te maken van een zeer lange cuvet kunnen zeer hoge gevoeligheden worden bereikt
Natuurlijk zijn er ook nadelen:
Ze meten alleen bepaalde groepen stoffen, meestal koolwaterstoffen. Andere brandbare gassen, b.v. ammoniak of koolmonoxide detecteren ze alleen op verschillende golflengten.
In de regel zijn ze iets duurder dan warmtetoners.
2.1.3 Vlamtemperatuursensoren
Zoals al beschreven bij de Davy-lamp verhoogt de aanwezigheid van een brandbaar gas de temperatuur van een vlam. Meestal wordt gebruik gemaakt van een waterstofvlam. Een nauwkeurige temperatuursensor in de vlam kan eenvoudig de door het gas veroorzaakte temperatuurstijging detecteren.
Vlamtemperatuursensoren hebben enkele voordelen:
- Ze zijn volledig gifproof
- Ze detecteren elk brandbaar gas
Natuurlijk zijn er ook nadelen:
- Je hebt brandstof nodig. Dit maakt de meting complex. De brandstofvoorziening vergt voortdurend onderhoud
- Je hebt zuurstof nodig
- Ze zijn relatief duur
- Meting van giftige gassen
3.1 Elektrochemische sensoren
Elektrochemische sensoren kunnen worden gezien als een batterij op gas. Zolang er geen gas is, gebeurt er niets. Zodra een bepaald gas de werkelektrode raakt, vindt er een reactie plaats waarbij elektronen worden geproduceerd of verbruikt. Deze stromen via een zeer gevoelig meetapparaat naar de tegenelektrode.
Deze gedetailleerde schets toont de processen aan de werkelektrode in detail. Het toont de draad van de werkelektrode van een waterstofsulfidesensor.
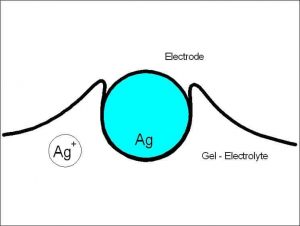 Werkelektrode voor Compur gasdetectoren
Werkelektrode voor Compur gasdetectoren
Bron: Compur Monitors
Wat gebeurt er nu precies?
Zilver oxideert in de lucht. Dit weten we uit het huishouden: zilveren bestek wordt zwart als het wordt blootgesteld aan lucht. Chemisch gezien wordt zilveroxide gevormd. Dit is in de vorm van ionen:
2 Agº -> 2 Ag+ + 4 e–
Dit proces gaat door totdat een evenwicht van elementair zilver en zilverionen is bereikt. Nu wordt er een gas toegevoegd dat reageert met de zilverionen: H2S + 2 Ag+ -> Ag2S↓ + 2 H+
Het zilversulfide is onoplosbaar. Hierdoor worden ionen uit de balans verwijderd. De werkelektrode wordt gedwongen nieuwe ionen en dus ook elektronen te genereren, die door het meetapparaat naar de tegenelektrode stromen. Er stroomt een stroom van meerdere nA.
Omdat elk gasmolecuul een specifiek aantal elektronen produceert, is de stroom evenredig met het aantal gasmoleculen dat erop botst. Nu is goed te voorspellen wat de hierboven beschreven sensor kan meten: alle gassen die met zilver een onoplosbaar zout vormen. Sterker nog, deze sensortechnologie wordt gebruikt om H2S, HCl, HCN en COCl2 te meten. Deze meetmethode is dus zeer specifiek. Bovendien is hij zo gevoelig dat hij ook gebruikt kan worden voor het betrouwbaar meten van gassen met zeer lage grenswaarden.
Door de juiste elektrodematerialen en het juiste elektrolyt te selecteren, kunnen sensoren worden ontwikkeld die zeer specifieke stoffen detecteren. Helaas zijn niet alle stoffen reactief genoeg om zonder extra energie met het gemeten gas te reageren. Daarom worden elektrochemische sensoren voornamelijk gebruikt om anorganische toxische gassen en zuurstof te meten.
Elektrochemische sensoren hebben enkele voordelen:
- Ze zijn extreem gevoelig. Zelfs concentraties in het ppb-bereik kunnen worden gedetecteerd
- Ze zijn heel specifiek
- Je hebt geen hulpenergie nodig.
Natuurlijk zijn er ook nadelen:
- Ze meten alleen reactieve gassen, meestal geen koolwaterstoffen.
- Ze zijn goedkoop
- Het sensorsignaal is recht evenredig met de concentratie
3.2 PID-sensoren
PID-sensoren maken gebruik van het feit dat UV-licht met zeer hoge energie gasmoleculen in radicalen breekt. Deze zijn elektrisch geladen. Geladen deeltjes kunnen eenvoudig worden geteld door ze door een cuvet te leiden waarvan de wanden elektrisch geladen zijn. Positief geladen deeltjes worden aangetrokken door de negatief geladen elektrode en omgekeerd. Daar compenseren ze hun elektrische lading. De ontlaadstroom is evenredig met het aantal moleculen i. e. van concentratie.
PID-functiediagram
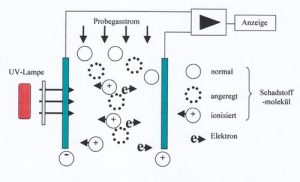
Bron: 2015 ABGS GmbH – Dipl.-Ing. Dieter Seyfert
Als UV-bronnen worden lampen met 10,6 of 11,7 eV gebruikt. Deze energie is niet voldoende om water-, zuurstof- of stikstofmoleculen te ioniseren. De PID reageert niet op stoffen die al in de lucht aanwezig zijn. Dit zijn echter zeer talrijke stoffen, vooral veel koolwaterstoffen. Helaas worden ze allemaal met verschillende gevoeligheid weergegeven.
De meeste van deze stoffen zijn vloeistoffen. Kalibratie met een vloeistof probeer je zoveel mogelijk te vermijden. Daarom is afgesproken om altijd met isobuteen te kalibreren en van zoveel mogelijk stoffen de referentiefactoren te bepalen ten opzichte van isobuteen. Hierdoor is het eenvoudig om met een gas te kalibreren. Deze factoren zijn terug te vinden in de literatuur, of b.v. hier:
https://www.compur.com/wp-content/uploads/Statox-501-PID-Response-Factors_D_E.pdf
PID-sensoren hebben enkele voordelen:
- Ze zijn extreem gevoelig. Zelfs concentraties in het ppb-bereik kunnen worden gedetecteerd
- Ze hebben een zeer brede band, waardoor er veel stoffen kunnen worden gemeten
- Ze meten ook relatief inerte gassen
Natuurlijk zijn er ook nadelen:
- Ze meten heel aspecifiek
- De lamp is een slijtageonderdeel
- Bij het meten van mengsels geven ze alleen een somsignaal


